Hallo zusammen,
in diesem
thread stellt
tauroplu die Frage,
warum sich die Druckverläufe einer identischen Charge in unterschiedlichen
Behältern aber bei sonst gleichen Bedingungen vergoren, im Gärverlauf
unterscheiden. Im Verlauf der Diskussion bringt
Dennis in Antwort 36
folgendes ins Spiel:
| Zitat von DerDennis, am 6.6.2014 um
18:07 |
Angenommen es war 1 Liter Kopfraum:
bei 1 bar (ca. Normaldruck) wiegt das CO2 darin 1,8
Gramm. Bei 2 Bar (1 Bar Überdruck) sind es 3,6g CO2.
Berechnung hiermit:
http://www.peacesoftware.de/einigewerte/co2.html |
Woher diese rund
1,8 g/l CO2 im Gasraum bei Normaldruck(1013
mbar) kommen möchte ich gerne und für die Interessierten herleiten
und am Ende des Beitrags berechnen, welchen Einfluß der Gasraum im
Gärbehälter auf den CO2-Gehalt im fertigen Bier im Rahmen geschlossener
Systeme(Fassgärung/Flaschengärung) hat:
Anmerkung:
Ich entschuldige mich gleich mal. Der Beitrag ist im Umfang eher etwas für
ein verregnetes Wochenende geworden als das er als kleiner Appetithappen
fürs technologische Grundverständnis dienen könnte

Der italienische Physiker Amadeo Avogadro
[1] fand folgendes
heraus:
1 mol
[2] irgend eines (idelaen
[3]) Gases hat
bei Normbedingungen (1013 mbar und 0°C) ein Volumen von
22,4 L
Die von
Avogadro gemachten Annahmen weichen für CO2 in engen Grenzen
ab, da es sich bei CO2 um kein Idealgas handelt.
Abweichung von Avogadros
Annahmen:
Beim
CO2 (Siede- bzw. Sublimationspunkt -78,5 °C) ist die Abweichung
vom Idealgas "
deutlich".
Das Molvolumen von CO2 ist statt
22,4 nur 22,25 l/mol bei 0 °C, bei
20 °C 23,88 l/mol
Es ergibt sich, dass man aus einem gemessenen Gasvolumen auf die
Teilchenzahl schließen kann. Der Zusammenhang der sich aus
Avogadros
Aussagen ergibt lässt sich in einer Formel relativ simpel
darstellen:
Molmasse des Gases (g/mol) / Molvolumen (l/mol) (bei 20°C) = Gasmasse
(g) / Volumen des Gasraumes (l)
Jetzt benötigt man nur noch die molare Masse von CO2, um die Gasmasse in g
berechnen zu können. Berechnung molare Masse CO2:
12(C) + 2 * 16(O) =
44 g/mol
CO2(siehe
Periodensystem[4] )
... und stellt die Formel nach der Gasmasse um. Für CO2 bei 1 bar (nicht 1
bar ü) und 1 L ergibt sich bei 20°C ein Gewicht in g von:
44 g/mol
-------- x 1 L =
1,83
g
24 l/mol (-> siehe oben, "Abweichung von
Avogadros Annahmen")
Wenn ich also eine 1 L Flasche so lange mit CO2 Gas spüle bis sämtliche
Luft verdrängt ist und dann den Deckel drauf schraube(drucklos), befinden
sich genau 1,83 g CO2 in der Flasche(bei 20°C). Für
Luft übrigens liegt der Wert bei
1,2 g/l (20°C)
Weiter formuliert Dennis:
Woraus ergibt sich dieser Zusammenhang,
der für das Beispiel bei 20°C ausformuliert so aussieht ? :
- 1 bar Normaldruck = 1, 83 g CO2 (0 bar ü)
- 1 bar Überdruck = 3,66 g CO2
- 2 bar Überdruck = 5,49 g CO2
- usw...
Nach
William Henry[5] ist diese
Vorgehensweise für uns zulässig. Wir dürfen einen linearen Zusammenhang
zwischen Druck und der Gasmasse annehmen(bei gleicher Temperatur).
Abweichung von Henrys
Annahmen::
Das Gasgesetz nach
Henry ist zwar nur bedingt anwendbar, da CO2 kein
ideales Gas ist und Teile davon mit Wasser zu Kohlensäure H2CO3
reagieren(CO2 + H2O -> H2CO3), allerdings reaagieren nur etwa 0,2% mit
dem Wasser zur Kohlensäure und wir können den linearen Zusammenhang den
Henry hergeleitet hat trotzdem für uns in Ansatz bringen.
Nach dem kleinen Ausflug in die Gasgesetze
[6] bleibt
natürlich die Frage welche Releavanz das für uns besitzt.
Diese Relevanz findet man immer dann, "
wenn etwas nicht ganz voll
wird", wenn "nicht vermeidbarer
Gasraum" ein Thema ist oder ganz
allgemein, wenn wir etwas
aufkarbonisieren,
entkarbonisieren
oder
belüften.
Man kann sich vor Augen halten, dass von all diesen Maßnahmen nicht nur die
Flüssigkeit um die es geht betroffen ist, sondern auch der Gasraum darüber.
Wenn man so möchte karbonisieren wir nicht nur die Flüssigkeit auf, sondern
auch den Gasraum.
Ein Beispiel für ein geschlossenes
System - Fassgärung:
Wir haben 35L Bier die zur Fassgärung anstehen und die drucklos bei 20°C
einen CO2-Gehalt von 1,7 g/L aufweisen. Zur Verfügung stehen zwei 20L
Behälter und wir möchten im Endprodukt 6,6 g/L CO2 erreichen. Der
Speiserechner spuckt aus, dass wir dafür rund 10 g/L Zucker benötigen(das
Zahlenmaterial ist für das Beispiel passend gerundet). Der CO2-Recher
spuckt aus, dass am Ende der Gärung bei 20°C rund 3 bar Druck auf dem
Behälter lasten müssen - dann sind die 6,6 g/L CO2 erreicht.
Ist es jetzt sinnvoller einen der 20L Behälter ganz zu füllen und den
anderen mit 15L oder macht es mehr Sinn beide Behälter gleichmäßig zu
unterfüllen(je 17,5L) ?
Um diese Frage zu beantworten, müssen wir 3 Varianten rechnen:
Variante 1 : 20L Behälter mit 5 L Gasraum
Variante 2 : 20L Behälter mit 2,5 L Gasraum
Variante 3 : 20L Behälter mit 0 L Gasraum
In einem
1.
Schritt berchnen wir für die drei Varianten die CO2-Menge in
Gramm die darin entstehen kann:
(-> Faktoren siehe
Ballingformel)
Variante 1: (20L - 5L Gasraum) x
10 g/L Zucker / 2,0 x 0,957 =
71,8
g CO2 die darin entstehen können.
Variante 2: (20L - 2,5L Gasraum)
x 10 g/L Zucker / 2,0 x 0,957 =
83,8
g CO2 die darin entstehen können.
Variante 3: (20L - 0L Gasraum) x
10 g/L Zucker / 2,0 x 0,957 =
95,7
g CO2 die darin entstehen können.
Jetzt sieht das erst mal so aus als würde z.B. in Variante 3 wesentlich
mehr CO2 entstehen als in Variante 1. Dem ist auch so in g ausgedrückt,
aber nicht ausgedrückt in g/L. Um zu kontrollieren, ob bis hier hin alles
richtig ist, berechnen wir je Variante und zur Kontrolle in einem
2.Schritt das
jeweilige
+ an CO2 in g/L das zu erwarten ist:
Variante 1: 71,8 g CO2 /
Füllvolumen 15 L =
+ 4,8 g/L
CO2
Variante 2: 83,8 g CO2 /
Füllvolumen 17,5 L =
+ 4,8 g/L
CO2
Variante 3: 95,7 g CO2 /
Füllvolumen 20 L =
+ 4,8 g/L
CO2
Passt. Für jede Variante stellt sich in der Theorie ein CO2-Gehalt in g/L
von:
1,7 g/L(Ist) + 4,8 g/L = 6,5 g/L
ein.
Die Abweichung von 0,1 g/L zum Ziel von 6,6 g/L lässt sich durch
Rundungsfehler erklären und durch die Tatsache, dass die Formel nach
Balling den Extraktbedarf als Mittel über den gesamten Gärverlauf
berechnet. Bei alleiniger Betrachtung der Speisegabe ist davon auszugehen,
dass weniger Extrakt für die Bildung der gleichen Menge CO2 nötig ist, da
der
Extraktverzehrer "Hefevermehrung" an dieser Stelle zu
vernachlässigen ist. Ich trage dem bereits in meinem
Speiserechner
Rechnung.
So weit so gut.
Aber:
Weiter oben steht es schon "
...Wenn man so möchte karbonisieren wir
nicht nur die Flüssigkeit auf, sondern auch den Gasraum".
Das bedeutet, dass diejenige Menge an CO2 die sich im Gasraum befindet
nicht mehr zur Aufkarbonisierung der Flüssigkeit zur Verfügung steht und es
stellt sich die Frage welcher CO2-Gehalt und welcher Druck sich für die
drei Varianten am Ende einstellt.
Für die
Variante 3 dürfte das klar sein, da kein CO2 für den Gasraum
in Abzug zu bringen ist. Es werden sich wohl ~ 6,6 g/L CO2 im Bier
einstellen.
Wie schaut das aber für die Variante
1 und 2 bei 20°C aus ?
Wir wissen von diversen CO2-Rechnern, dass sich bei 0 bar ü und 20°C ~ 1,66
g/L CO2 im Bier befinden. Von
Avogadro wissen wir, dass sich bei
20°C und 0 bar ü 1,83 g/L CO2 im Gasraum befinden. Weiter kennen wir das
Gesetz nach
Henry und können über diesen linearen Zusammenhang die
g CO2 im Gasraum einerseits und wissen von diversen CO2-Rechnern
andererseits, dass sich mit Verdopplung des Drucks bei gleicher Temperatur
auch der CO2-Gehlalt in g/L im Bier verdoppelt.
Weiter wissen wir, das sich Gas- und Flüssigkeitsphase im Gleichgewicht
befinden
[7][8](ggf. die Probe homogenisieren, kräftig
schütteln)
Man kan also formulieren, dass sich bei 20°C und pro bar Druckerhöhung die
Flüssigkeitsmenge um jeweils 1,66 g/L CO2 anreichert und der Gasraum der
darüber steht um 1,83 g/L CO2.
Für die Anreicherung mit CO2 bei
20°C gilt also folgender Zusammenhang:
g CO2 im Gasraum = Gasraum L * 1,83 g/L CO2 * bar ü
g CO2 im Bier = Bier L * 1,66 g/L * bar ü
Damit lässt sich wunderbar rechnen und weil mir das mit den Formeln hier zu
krakelig ist, hab ich die Zusammenhänge in einer Exceltabelle
[9]
aufgetragen und in der letzten Zeile die Spaltenformeln dazu
angezeigt(Zeile 23) - ganzheitlich gilt eine Bezugstemperatur von 20°C
Bild 01(Variante 3): Kontrolle -
Gasraum 0 L ,
Bier
20 L.
Lt. Berechnung im 1.Schritt nimmt der CO2-Gehalt um 95,7 g zu, es
müsste sich ein Druck von 3 bar und ein CO2-Gehalt von ~
6,6 g/L einstellen.
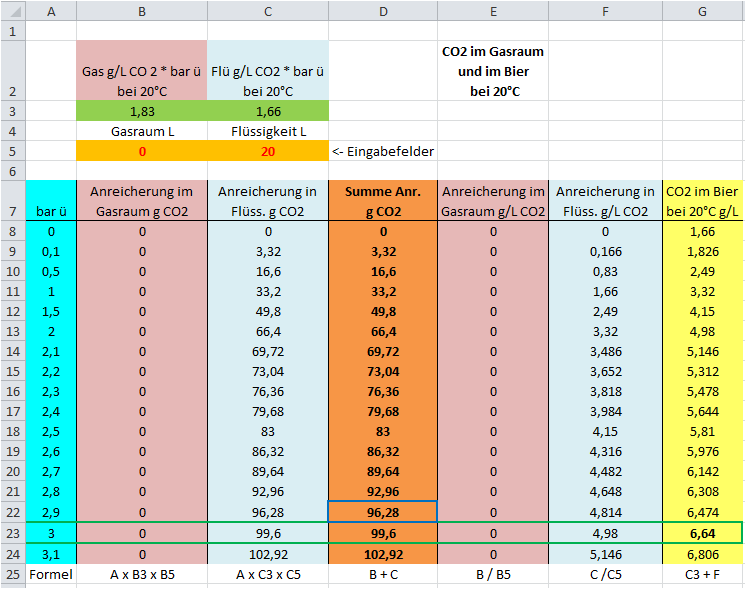
Interessant ist die
Zeile 23. Hier finden wir für die 3 bar Druck in
der Spalte
G den zugehörigen CO2-Gehalt von
6,64 g/L CO2. Das passt also schon
mal.
Die Spalte
D zeigt die Summe der CO2-Menge in g die sich nach der
oben aufgestellten Gesetzmäßigkeit im Gasraum und in der Flüssigkeit bilden
kann. Ebenfalls in
Zeile 23 finden wir dort den Wert
99,6 g
CO2.
Im
1. Schritt hatten wir
für
Variante 3 95,7 g CO2 berechnet die entstehen können,
hier sind es jetzt
99,6 g CO2... und auch hier sind die
Ungenauigkeiten und die Rundungsfehler die Ursache. Der
blaue Rahmen
markiert den Bereich der den 95,7 g am nächsten kommt und wenn man sich den
Druck dazu ansieht(2,9 bar ü) wird klar, dass wir hier von ein wenig mehr
als von
0,1 bar ü reden - das passt also auch.
Jetzt wird es spannend. Welcher CO2-Gehalt in g/L ist für die Variante 1 im
fertigen Bier zu erwarten. In Variante 1 ist gegeben eine Aufspeisung von
10 g/L Zucker mit einem Zielwert von 6,6 g/L CO2 im fertigen Bier. Der 20 L
Behälter wird nur bis zur 15 L Marke befüllt, der Rest ist Gasraum.
Bild 02(Variante 1): Gasraum
5 L ,
Bier 15 L.
Lt.
Berechnung im 1.Schritt nimmt
der CO2-Gehalt um 71,8 g zu.
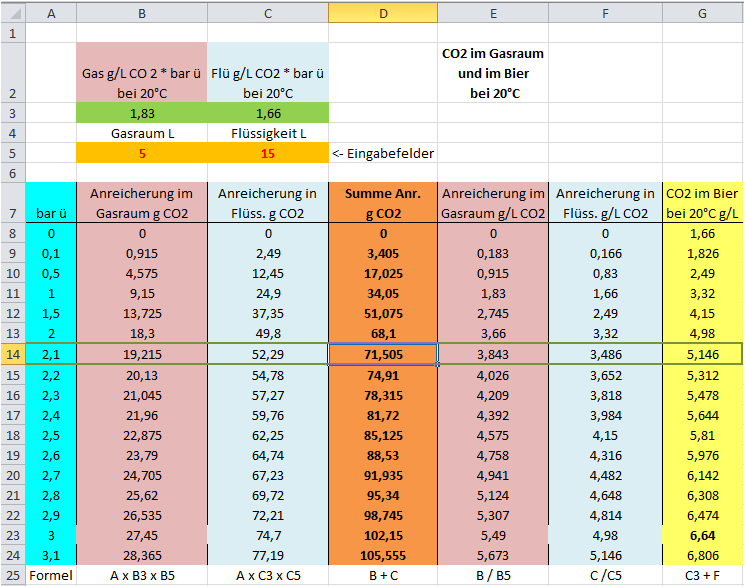
Jetzt gehen wir mit dem berechneten Wert aus
Schritt 1(Variante 1)
von
71,8 g CO2 Zunahme in
die Spalte
D und suchen dort den Wert der dieser Berechnung am
nächsten kommt - das ist die
Zeile 14. In der Spalte
A können
wir einen zugehörigen Druck von
2,1 bar ü und in Spalte
G
einen zugehörigen CO2-Gehalt im Bier von
5,146 g/l CO2 finden -
es fehlen also in einem 20L Behälter mit 5 L Gasraum ~ 1,5 gr/L CO2 zum
Wunschwert.
... und wie sieht das aus, wenn ich den Behälter mit dem Gasvolumen von
5 L mit 1 bar ü vorspanne und zuvor durch einleiten von CO2 in den Gasraum
die Luft mit CO2 verdrängt habe ?.
Nun, wir müssen diese Vorspannmenge an CO2 zu derjenigen Menge CO2 die
durch die Aufspeisung hinzukommt hinzuaddieren(Variante 1, Schritt 1):
71,8 g CO2 durch Aufspiesung + 1 bar ü x 1,83 g/L CO2 * 5 L Gasraum =
80,95 g CO2
Mit diesen
80,95 g CO2 gehe ich jetzt wieder in
Bild 02 in
die Spalte
D und finde ihn genähert in Zeile 17(81,72). Den
zugehörigen Druck und den CO2-Gehalt im Bier kann ich in Spalte
A
und
G finden.( Druck knappe 2,4 bar ü und knappe ~ 5, 6 g/L CO2
im Bier - immer noch zu wenig.
Wie schaut das aus, wenn ich den Behälter(Variante 1) mit 3 bar
vorspanne ?
71,8 g CO2 durch Aufspiesung + 3 bar ü x 1,83 g/L CO2 * 5 L Gasraum =
99,25 g CO2
Mit diesen
99,25 g CO2 gehe ich jetzt wieder in
Bild 02 in
die Spalte
D und finde ihn genähert in Zeile 22(98,745). Den
zugehörigen Druck und den CO2-Gehalt im Bier kann ich in Spalte
A
und
G finden( Druck 2,9 bar ü und ~ 6, 5 g/L CO2 im Bier) -
BINGO.
Wenn ich also
Variante 1 mit 3 bar
vorspanne und
Variante 3
überhaupt nicht(oder nur ein wenig, eben so, dass der Topf ggf. dicht
wird),
darf ich am Ende in beiden Chargen einen CO2-Gehalt von ca. 6,6 g/L
erwarten. Gehe ich nicht so vor, wird
Variante 1 am Ende 1,5 g/L CO2 weniger im Bier haben.
Wer möchte kann sich die Exceltabelle
[9] runterladen und selbst ein
wenig rumspielen, z.B. mit 0,5 L Flaschen. Der Umgang mit der Tabelle
spielt sich immer nach dem selben Muster ab:
- Berechnung CO2-Menge in Gramm die aus einer Zuckerdosage
und einer Flüssigkeitsmenge mit überstehendem Gasvolumen entstehen kann:
g CO2 = ( Behältervolumen L - Gasraumvolumen L ) x Dosage g/L Zucker / 2,0
x 0,957
Beispiel 0,5 L Flasche, Gasraum 0,025 L(25 ml):
(0,5 L - 0,025 L Gasraum) x 10 g/L Zucker / 2,0 x 0,957 = 2,27 g CO2 die darin entstehen
können.
- In der Exceltabelle trägt man im Feld B5 den Gasraum in L ein, hier
0,025 L, und im Feld C5 erfasst man das Füllvolumen, hier 0,475
L(0,5-0,025)
- Mit dem berechneten Wert für die g CO2 aus 1., hier 2,27 g, geht man in
die Spalte D und sucht die Zeile mit dem Wert der den 2,27 g am nächsten
kommt. In dieser Zeile kann man dann alle zugehörigen Werte ablesen, z.B.
den Druck(Spalte A) und den CO2-Gehalt im Bier g/L(Spalte G)
Fazit:
Das Verhältnis Gasraum zu Flüssigkeitsraum in einem geschlossenen Behälter
wirkt sich in der Form auf den zu erwartenden CO2-Gehalt g/L im fertigen
Bier aus, dass mit zunehmendem Gasraum der CO2-Gehalt im Fertigbier
abnimmt. Daraus lassen sich weitere Schlussfolgerungen ziehen(fest gemacht
an einer Messung des CO2-Gehaltes und das deshalb, da das Maß der Fehler
die hier auftreten können 1:1 auf das Maß der Fehler bei der
Speiseberechnung übertragbar sind).
- Eine CO2-Messung
basierend auf Druck und Temperatur wird falsch, wenn sich ein Gasraum in
der Probe befindet. Bereits ein Verhältnis von Gasraum zu Flüssigkeitsraum
von 1:8 und kleiner(z.B. 1:7) wirkt sich mit > 0,5 g/L CO2
Unterschied zum wahren Wert aus(-> Das Verhältnis 1:8 entspricht in
einem 20 L Behälter einem Gasraum von 2 L und in einer 0,5 L Flasche einem
Gasaum von 50 ml)
- Vor einer CO2-Bestimmung Mittels Druck und Temperatur ist die Probe
kräftig zu schütteln. Stichwort
"Lösungsgeschwindigkeit"[8](II.Kinetik der Gasadsorption).
Einfach formuliert: "wenn es mir in den Sinn kommt zu messen ist noch
lange nicht sicher gestellt, dass sich der zugehörige Druck zur aktuellen
Temperatur und zum Ist-CO2-Gehalt bereits eingestellt hat". Das ist
erst dann sicher gestellt, wenn durch schütteln die nötigen
Diffusionsvorgänge zwangsweise in Gang gesetzt wurden. Oder noch simpler: Die Probe muss einfach homogen sein
!
- In einem geschlossenem System(Flaschengärung, Fassgärung -> kein
Spundapparat) spielen Unterschiede im statischen Druck keine Rolle(->
unterschiedliche Füllhöhe Fass/Flasche). Es kann sich einerseits nicht mehr
CO2 bilden als das der vergärbare Extrakt vor der Vergärung liefern kann
und andererseits werden Unterschiede oben/unten durch die
Homogenisierung(schütteln) der Probe ausgeglichen(s.o.).
- Möchte ich den Nachgärungsverlauf eines identischen Substrates das in
unterschiedlich grossen Behältern bei sonst gleichen Bedingungen vergoren
wird kontrollieren oder vergleichen, sind die Proben vorher zu schütteln,
da auch hier neben den reinen Bindungsvorgängen der CO2 die
unterschiedliche Lösungsgeschwindigkeiten eine Rolle spielen. Mit
unterschiedlichem Verhältnis von Gasraum zu Flüssigkeitsvolumen und
zunehmendem Gasraum und Diffusionsflächen können sich die
Lösungsgeschwindigkeiten so weit unterscheiden, dass kein direkter
Vergleich der Proben mehr möglich ist -> Homogenität der
Probe(schütteln).
- Die Verweise ganz unten zeigen das Ausmaß der Geschichten die sich
zwischen einer Gas-und Flüssigkeitsphase bzw. beim auf- und
endkarbonisieren abspielen. Zum Glück befinden wir uns in solch einer
komfortablen Situation, dass uns in diesem Zusammenhang nicht jedes Detail
interessieren muss und eine Speiseberechnung auch dann als gelungen
angesehen werden kann, wenn anstatt der berechneten 5,3 g/L nur 5,0 g/L
oder 5,6 g/L dabei rauskommen.
Hier darf auch jeder seine eigenen Grenzen ziehen und selbst einsortieren
was ihm wichtig, egal oder unwichtig ist. Am Ende bleiben aber auch für uns
ein paar Gesetzmäßigkeiten übrig die man immer dann auf dem Zettel haben
sollte, wenn wir Werte miteinander vergleichen möchten, wenn Fehlerursachen
beratend oder für sich selbst gefunden werden sollen und vor allem immer
dann, wenn gemessen wird.
Es ist also durchaus erlaubt mal zu hinterfragen wie denn ein Meßwert
überhaupt zustande gekommen ist, bevor man anfängt sämtliche
technologischen Details bis in alle untiefen hinein auszuloten.
Gruß Oli
P.S.: Korrekturen und Fehlerhinweise sind jederzeit erwünscht.
Quellen und Verweise:
[1]
http://de.wikipedia.org/wiki/Avogadro-Konstante
[2]
http://de.wikipedia.org/wiki/Mol
[3]
http://de.wikipedia.org/wiki/Ideales_Gas
[4]
http://de.wikipedia.org/wiki/Periodensystem
[5]
http://de.wikipedia.org/wiki/Gesetz_von_Henry
[6]
http://de.wikipedia.org/wiki/Gasgesetze
[7]
http://www.iup.uni-heidelberg.de/institut/studium/lehre/Aqu
aPhys/docMVEnv3_12/AqSysSkript_Kap6.pdf
[8]
http://e-collection.library.ethz.ch/eserv/eth:20129/eth-201
29-02.pdf
[9]
http://www.brewrecipedeveloper.de/misc/samples/CO2imGasraum
UndImBierBei20Grad.zip
Edith sagt: Dem Fehlerteufel die Stirn geboten.
[Editiert am 2.7.2014 um 09:13 von olibaer]
____________________
http://www.brewrecipedeveloper.de 



 Startseite
Startseite
 Forumsübersicht
Forumsübersicht
 Impressum
Impressum