Posting Freak   Beiträge: 675 Registriert: 25.10.2010 Status: Offline |
 |
erstellt am: 9.12.2011 um 14:33 |
|
|
Hallo Earl - ich hätte eher vermutet, dass ein obergäriges Bier durch die
schnellere Gärung eher zur Übersättigung neigt als ein untergäriges, dass
mehr Zeit hat zum ausgasen. Aber Gegentheorie zu eben gesagtem: vielleicht
tritt das CO2 bei schnellerer Gärung grossblasiger aus und die
Übersättigungstendenz ist daher eher geringer??? Ich weiss - alles ziemlich
windig.
Gruß
Sandro
____________________
|
 |
Antwort 25 |
|
Moderator   Beiträge: 4922 Registriert: 5.4.2005 Status: Offline |
 |
erstellt am: 9.12.2011 um 22:15 |
|
|
Habe es mal versucht zu messen, dürften aber aufgrund von möglichen
Meßfehlern ziemlich ungenau sein, aber erstmal egal.
Ich habe vom ausegegorenen Untergärigen ca. 225ml in ein 250er Becherglas
gezapft. Die Gärung steht bei 11°C Raumtemperatur.
Nach dem fabier-Rechner müßten somit etwa 2,2g/l CO2 drin sein (0bar
Überdruck = Atmosphärendruck).
In 225ml wären es etwa 0,5g (0,495), das Volumen ist aber nur am Becherglas
abgelesen und somit nicht so genau.
Die gezapfte Probe wiegt incl. Becherglas 328,70g. Einen Minischneebesen
eingetaucht und wieder rausgezogen und zurück abtropfen lassen sind es noch
328,60g
Dann den Schneebesen länger und mehrfach gewirbelt (wie einen Quirl
zwischen den Handflächen) und den Schneebesen wieder gut abtropfen
lassen.
Zuletzt hatte ich 328,05g im Glas und geschmacklich war das Bier danach
schal (wie will man sonst die Abwesenheit von Rezenz testen, außer mit dem
Mund?  )
Läßt man alle möglichen Meßfehler weg, wäre die Ausgangsprobe ca. 10%
stärker carbonisiert, als rechnerisch der Sättigungsdruck von 0bar
Überdruck bei 11°C ergäbe.
Später ist mir eingefallen, daß ich ja auch eine größere Probenmenge in
einer Petflasche abwiegen und gut ausschütteln könnte.
Leider habe ich aber gerade keine solche Flasche da. 
Uwe
|
  |
Antwort 26 |
|
Posting Freak   Beiträge: 675 Registriert: 25.10.2010 Status: Offline |
 |
erstellt am: 12.12.2011 um 08:35 |
|
|
Könnte die Übersättigung nicht, zumindest teilweise, mit dem durch die
Jungbiersäule erzeugten Überdruck zu tun haben? In 1m Wassertiefe haben wir
einen Überdruck von 100 mbar - die meisten Gärgefäße von uns sind zwar
flacher, aber 30-60 mbar ist wohl realistisch. Wieviel mehr CO2 löst sich
unter diesen Bedingungen?
Mir ist auch aufgefallen, dass eine gewisse Menge CO2 mit der sich
absetzenden Hefe am Boden gefangen wird und die durch das Abfüllen wieder
frei wird (Bewegung des Gäreimers, Absinken des Drucks etc.)
Viele Grüße
Sandro
____________________
|
 |
Antwort 27 |
|
Posting Freak   Beiträge: 1181 Registriert: 19.9.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 12.12.2011 um 08:51 |
|
|
Das wäre aber eine komplexe Berechnung, denn der Überdruck nimmt ja zur
Oberfläche hin wieder ab. Der statische Druck nimmt zwar mit der Tiefe der
Flüssigkeitssäule zu, ist dann aber nur der Überdruck an dieser Stelle des
Fasses. Das CO2 Verhalten im Fass ist an jeder Höhenlage des Fasses anders.
Ein Mittelwert ist also dann eher zur Berechnung mit einzubeziehen.
Gruß Matze
____________________
Auch Wasser ist ein edler Tropfen, kocht man es mit Malz und
Hopfen.
|
  |
Antwort 28 |
|
Posting Freak   Beiträge: 1053 Registriert: 15.2.2006 Status: OfflineGeschlecht:  |
 |
erstellt am: 12.12.2011 um 10:10 |
|
|
Hallo Kollegen,
da ich leider nicht mehr viel im Forum unterwegs sein kann, ist mir die
interessante Diskussion erst jetzt aufgefallen.
Das gleiche Problem habe ich mit meinem Speiserechner (in Mash-It) auch
schon festgestellt. Dann habe ich mir mal die Mühe gemacht und die
Hanghofer-Formel mathematisch analysiert.
Das erste, was mir aufgefallen ist, war, dass die Hanghofer-Formel immer
davon ausgeht, dass man _zusätzliche_ Speise zur kompletten gebrauten Würze
dazugibt.
Beispiel: Würzemenge = 10 liter, berechnete Speise = 1 liter => Das
bedeutet, dass man noch einen zusätzlichen Liter dazugeben muss und dann
auf 11 liter kommt.
Ich hatte das vorher immer so interpretiert, dass ich _von den 10 litern_
vor der Vergärung einen liter abziehen muss und später wieder als Speise
dazugeben. => Gesamtmenge = 10 liter.
Bei der Denkweise ist aber 1 liter Speise zu viel, es müssten nur 900 ml
statt einem liter speise sein. Also habe ich in dem Beispiel 10% zuviel
speise gegeben.
Bestimmt hat der Hanghofer das in seinem Buch genau beschrieben, aber _ich
Hirni_ habe es wohl übersehen.... 
Ich habe die Formel nochmal für den Fall hergeleitet, dass man von der
gebrauten Würze die Speise abzieht, leider finde ich sie grade nicht...
Wenn Ihr wollt, liefere ich sie noch nach...
Das allein erklärt aber nur einen Teil des Problems. (Scheint trotzdem
immer noch zu viel Karbonisierung zu sein).
Gruß,
Axel ____________________ Hallo Leute, bin leider nur noch selten hier unterwegs und antworte daher
kaum mehr wenn Ihr mir PMs schickt.
Yahoo-Messenger: DunkelBrauer
Braupage: http://www.SelberBierBrauen.De
Brausoftware: http://www.BrauSoftware.De
|
  |
Antwort 29 |
|
Posting Freak  Beiträge: 824 Registriert: 14.6.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 20.12.2011 um 13:18 |
|
|
Hallo,
zum Thema habe ich seit einigen Tagen ein Versuch am laufen. Ich lasse
gerade eine Zuckerlösung in einer Druckprüfflasche gären. Das Wasser für
diese Lösung hatte ich abgekocht und in einem gasdichten Gefäß auf 20°C
herunter gekühlt. Das Wasser sollte also entgast und somit eine
CO2-Übersättigung absolut ausgeschlossen sein. Die Lösung enthält 5,80 g
Haushaltszucker in 500 ml entgastem Wasser. Diese Menge hatte mein
Speiserecher ausgerechnet für einen CO2-Enddruck von exakt 2,50 bar bei
20°C. Bei der Zuckerberechnung hatte ich eine Jungbiertemperatur von über
100°C angegeben, da ich die Flüssigkeit zuvor ja vollständig entgast hatte.
Die Probe an sich brachte also kein eigenes CO2 mit sich. Mir erscheint
diese Vorgehensweise zwar logisch, aber vielleicht ist ja doch jemand
anderer Meinung.
Der Druck steht mittlerweile bei 2,7 bar und er scheint weiter zu steigen
 .
Gruß
Earl ____________________ PS: HIER gehts zur Tauschbörse für Hobbybrauer 
|
|
|
Posting Freak   Beiträge: 675 Registriert: 25.10.2010 Status: Offline |
 |
erstellt am: 20.12.2011 um 13:40 |
|
|
Hallo Earl,
Deine Vorgehensweise finde ich sehr durchdacht - eigentlich sollte alles
stimmen.
Adhoc würden mir nur zwei Fehlerquellen einfallen: da wäre die Temperatur
beim ablesen. Ab >23°C wären es >2,7 bar - aber das hast Du sicher
gecheckt. Ist das Thermometer verlässlich?
Eine weitere Möglichkeit besteht in der Hefe selbst, die sich am Ende des
Zuckers anfängt selbst zu veratmen. Dies könnte man mal kontrollieren in
dem man eine gut gefütterte Hefekultur in das von Dir beschriebene Setup
einsperrt (allerdings ohne Zucker) und - falls der Druck steigt - diesen
Wert von Deinem Experiment abzieht.
Gruß
Sandro
[Editiert am 20.12.2011 um 13:42 von muldengold]
____________________
|
 |
Antwort 31 |
|
Posting Freak  Beiträge: 824 Registriert: 14.6.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 21.12.2011 um 23:15 |
|
|
so, die Manometernadel ist nun endlich zum Stehen gekommen, mein erstes
Experiment ist somit beendet. Die Nadel zeigt 2,75 bar an, bei exakt
19,5°C. Das sind dann umgerechnet etwa 2,8 bar bei 20°C. Die Differenz zum
Zielwert von 2,5 bar beträgt also 0,3 bar. Das Bier würde vom Speiserechner
demnach mit 0,5 g/l zu hoch karbonisiert worden sein, unter Verwendung von
Haushaltszucker. Die Ursache hierfür ist mir nach wie vor unbekannt, der
Fehler sollte jedoch in der Zuckerberechnung liegen. Da nicht zu wenig,
sondern zu viel Druck angezeigt wurde und ich beim Ansetzen der Lösung sehr
ordentlich gearbeitet hatte, werde ich den Versuch bei 20°C nicht
wiederholen. Ich werde jedoch einen Versuch bei 5°C und bei 10°C
unternehmen.
Die übliche Abweichung der Speiserechner beträgt nach meiner bisherigen
Erkenntnis etwa + 1 g/l. Das weitere halbe Gramm könnte aus der vermuteten
Übersättigung resultieren.
@ Sandro, danke für den Tipp mit der Hefezersetzung. Das klingt plausibel
und ich werde dies als nächstes testen.
@ All, Vielleicht kann jemand von uns ja mal eine Parallelversuch
unternehmen.
Viele Grüße
Earl ____________________ PS: HIER gehts zur Tauschbörse für Hobbybrauer 
|
|
|
Posting Freak   Beiträge: 1053 Registriert: 15.2.2006 Status: OfflineGeschlecht:  |
 |
erstellt am: 22.12.2011 um 08:36 |
|
|
Hallo Earl,
ich hatte mir aufgrund dieses Threads schon vorgenommen, über die Feiertage
einmal ein paar Versuche zu fahren, weil es mich genauso interessiert.
Ich mache also gerne mit.
Vielleicht können wir hier ja gemeinsam zu einem Korrekturfaktor kommen und
die so "verbesserte" Formel hier veröffentlichen.
Ich möchte mit Malzextrakt arbeiten und folgende Versuche machen:
a) Direkte Vergärung bei versch. Extraktgaben (Entgastes Wasser wird mit
Extrakt versetzt und die Probe gärt bei rel. hoher Temp. => SVG).
b) Das Ergebnis aus diesen Versuchen wird dann auf verschiedene
Temperaturen gebracht und jeweils nach zwei Tagen der Druck bei der
Temperatur abgelesen... (Temperatur- Druck- Reihe => Gelöstes CO2
bestimmen bei jeder Temp)
c) Gleiche Versuchsreihen wie bei a)+b), nur dass diesmal ein nicht
entgastes, aber druckfreies Jungbier mit Extrakt aufkarbonisiert wird.
Leider habe ich nur ein Flaschen-Manomenter, daher werden die Versuchsrehen
etwas dauern...
Gruß,
Axel ____________________ Hallo Leute, bin leider nur noch selten hier unterwegs und antworte daher
kaum mehr wenn Ihr mir PMs schickt.
Yahoo-Messenger: DunkelBrauer
Braupage: http://www.SelberBierBrauen.De
Brausoftware: http://www.BrauSoftware.De
|
  |
Antwort 33 |
|
Junior Member  Beiträge: 32 Registriert: 10.10.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 22.12.2011 um 09:55 |
|
|
Hallo Earl,
wäre es eventuell sinnvoll, vor der letzten Druckmessung die Probe nochmals
über ein, zwei Tage in den Kühlschrank zu stellen und sie dann am nächsten
Tag erst wieder langsam auf 20°C aufwärmen zu lassen? Eventuell bindet sich
das CO2 dann besser/schneller? Ich glaube mal gelesen zu haben, das es etwa
96 Stunden dauert bis sich das CO2-Gleichgewicht einigermaßen eingestellt
hat.
|
 |
Antwort 34 |
|
Posting Freak  Beiträge: 824 Registriert: 14.6.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 23.12.2011 um 12:57 |
|
|
Hallo Kleier,
danke für Deine Kritik. Ich glaube jedoch nicht, dass diese Vorgehensweise
zu einem sehr viel besseren Ergebniss führen würde. Das CO2 entsteht ja
während der Gärung durch enzymatische Vorgänge direkt an der Oberfläche der
Hefezelle und wird sozusagen von ihr molekelweise in die Flüssigkeit
gedrückt. Zudem hatte ich die Hefe durch drehen der Flasche zwischen den
Handflächen täglich einmal aufgeschlämmt. Das sollte doch zu einer
optimalen CO2-Bindung führen. Die Flasche steht jetzt seit dem 15.12, das
sind 192 Stunden. Der Druck ist nach wie vor unverändert. Ich hatte auch
noch nie bei einer Druckgärung festgestellt, dass die Manometernadel am
Ende der Gärung aufgrund weiterer CO2-Bindung später wieder abfällt. Das
tat sie nur bei einer undichten Druckprüfflasche. Trotzdem werde ich die
Flasche nun doch kühl stellen, um herauszufinden wie die Löslichkeit des
CO2 bei 10°C und später bei 5°C sein wird. Axels Vorschlag b) sozusagen
 . Dazu werde ich, wie Du mir vorschlugst, die Probe
mindestens 96 Stunden bei der jeweiligen Temp. stehen lassen,
sicherheitshalber vielleicht etwas länger. Am Ende des Versuchs temperiere
ich dann wieder auf RT um zu sehen ob Dein Kritikpunkt vielleicht doch
zutrifft. Ich hoffe, die Flasche hält über diesen langen Zeitraum zu 100%
dicht.
Viele Grüße
Earl
[Editiert am 23.12.2011 um 13:02 von Earl]
____________________ PS: HIER gehts zur Tauschbörse für Hobbybrauer 
|
|
|
Posting Freak   Beiträge: 678 Registriert: 23.3.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 23.12.2011 um 13:21 |
|
|
Ich hätte auch noch eine Idee. Wenn ich eine abgefüllte Flasche Bier habe
und steche mit einem Manometer hinein und lese dann den Druck ab,
kombiniere ihn mit der Biertemperatur und schaue in der Tabelle den CO2
Gehalt nach, dann stimmt dieser nicht, da der Druck schon nicht richtig
war. Der CO2 Druck im Bier ist nämlich höher als der im Kopfraum der
Flasche. D.h. man muss die Flasche so lange schütteln bis zwischen Kopfraum
und Bier ein Druckgleichgewicht herscht. Erst jetzt kann man den richtigen
Druck ablesen.
Übertragen auf das obige Problem würde das bedeuten, dass du aufzuckerst
(z.B. mit 100g), dein Manometer aufschraubst und vergären lässt. Jetzt
stellt sich die Manometernadel auf beispielsweise 1bar Überdruck ein. Du
misst die Temperatur und erhälst den CO2 Gehalt und schlussfolgerst, dass
du so viel zucker benötigst um eben diesen CO2 Gehalt zu erhalten. Aber
dieser stimmt nicht, da du ja wie oben schon gesagt schütteln musst. Jetzt
stellt sich z.B. 1,2bar ein und somit der korrekte Druck. Das bedeutet,
dass schon 80g Zucker gereicht hätten. Somit stellt sich der Druck während
der Gärung, bei Verwendung von nur 80g Zucker, nur auf 0,8bar ein. Nach dem
Schütteln aber geht die Nadel auf 1bar.
Evtl. liegt da der Hund begraben?!
Die Zahlen sind beliebig gewählt!
Gut Sud
Matthias
____________________
|
 |
Antwort 36 |
|
Posting Freak   Beiträge: 675 Registriert: 25.10.2010 Status: Offline |
 |
erstellt am: 23.12.2011 um 18:12 |
|
|
Bierhias: aus einem Bauchgefühl her würde ich Dir recht geben - obwohl ich
mir nicht sicher bin ob sich die Manometernadel nach Schütteln auch nur
einen Millimeter bewegen wird.
Mir ist noch eine Sache zu Earl's Experiment eingefallen: durch Abkochen
geht ganz klar die Kohlensäure CO2-Fraktion verloren. Was aber ist mit dem
Bikarbonat? Das gast ja nicht so einfach aus. Im Gegenteil, es fällt durch
(längeres) Kochen eher als Karbonat aus, welches sich später im Experiment
wieder als Bikarbonat bzw. Kohlensäure rücklöst und dadurch die
Manometernadel nach oben schiebt??? Ach man, ich weiss selbst langsam nicht
mehr was Fakt ist. Hier müsste mal ein Wasserchemiker Klartext reden!
Gruß
Sandro
____________________
|
 |
Antwort 37 |
|
Posting Freak  Beiträge: 824 Registriert: 14.6.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 23.12.2011 um 18:52 |
|
|
Hi Sandro  ,
ist doch nicht so tragisch, wir schaffen das schon! Trotzdem danke für
diesen Kritikpunkt.
Wir verwenden für künftige Versuche einfach destilliertes Wasser. Axel, ich
hoffe, dieser Vorschlag kommt noch rechtzeitig. Matthias, ich habe meine
Manometerflasche noch nie kräftig geschüttelt. Vielleicht sollte ich es bei
den gleichen Bedingungen lassen. Zum Ende des Versuchs stelle ich aber
trotzdem mal die Flasche ins Ultraschallbad, mal sehen was passiert. Sandro
and all: wenn Ihr gerade eine Druckprüfflasche frei habt, dann könnt Ihr
doch auch mal einen Versuch mitmachen? Leider ist meine Flasche gerade
besetzt, sie steht nun bei 7°C im Kühlschrank.
LG
Earl
[Editiert am 23.12.2011 um 19:03 von Earl]
____________________ PS: HIER gehts zur Tauschbörse für Hobbybrauer 
|
|
|
Posting Freak   Beiträge: 678 Registriert: 23.3.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 23.12.2011 um 19:12 |
|
|
Die Manometernadel wird sich definitiv bewegen. In der Brauerei mach ich
täglich CO2 Messungen. Die haben da sogar eine Maschine, die die Flaschen
durchschüttelt. Sobald sich die Nadel dann wirklich nicht mehr bewegt ist
der richtige Druck erreicht.
Ich habe auch immer gedacht, dass der angezeigte Druck am Manometer dem
wirklichen Druck entspricht, bis mir eben ein Laborleiter das erklärt hat.
Hab gerade nochmal im Mebak nachgeschlagen, da wird das selbe beschrieben.
Die Flasche muss vor der Ablesung durchgeshcüttelt werden bis sich das
Druckgleichgewicht eingestellt hat. Diese Methode bringt minimal erhöhte
Ergebnisse, weil die Luft im Flaschenhals nicht berücksichtigt wird.
Klar, die Bedingungen muss man schon gleich lassen, aber wenn man ein
falsch kalibriertes Thermometer hat und alle Parameter immer gleich lässt,
wird das Thermometer trotzdem immer 50°C anzeigen, obwohl die korrekte
Temperatur 48°C ist.
Für mich klingt das alles recht plausibel und wenns sogar im Mebak steht,
wirds schon so seine Richtigkeit haben.
____________________
|
 |
Antwort 39 |
|
Posting Freak  Beiträge: 824 Registriert: 14.6.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 23.12.2011 um 19:46 |
|
|
Hi Matthias,
OK. Ich hatte bisher nie geschüttelt, weil ich kein Bier in der
Manometerspirale haben wollte. Aber, wir machen´s natürlich so wie´s im
Mebak steht! Ich hoffe, ein Ultraschallbad erfüllt den selben Zweck?
Das hieße ja aber dann, das die Speiserechner über dieses 1 g/l hinaus
überkarbonisieren würden? 
LG
Earl ____________________ PS: HIER gehts zur Tauschbörse für Hobbybrauer 
|
|
|
Posting Freak   Beiträge: 678 Registriert: 23.3.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 24.12.2011 um 09:58 |
|
|
ja, das wäre durchaus möglich. Ich glaube auch, dass es einfach viel mit
Geduld zu tun hat. Ein Weißbier in der Nachgärung z.B. braucht 2-3 Wochen
bis wirklich der komplette Extrakt vergoren ist. Lese ich den Wert für die
Programmierung des CO2 Rechners schon nach ein paar Tagen ab und
schlussfolgere, dass es soviel Zucker/Speise für so viel CO2 benötigt, dann
ist das ja auch wieder ein falscher Wert.
Ich war selbst überrascht als ich die Weißbiere gemessen habe. Nach einer
Woche Nachgärung ca. 6,2g/L, nach zwei 6,9g/L und nach drei Wochen stieg es
nochmal auf 7,2g/L. Und erst nach dieser Zeit geht das Weißbier in den
Verkauf. Ist aber dann auch wirklich fertig vergoren.
Gut Sud
Matthias
Edit: Mir fällt gerade noch ein. Speise ist ja nicht gleich Speise! Wie
hoch sie vergärt hängt ja auch vom Maischverfahren bzw. vom
Endvergärungsgrad ab. Und wenn man auch hier zu früh die Werte abliest,
dann ists ja wieder flasch. Auf die Geduld läuft sich alles zusammen. Man
muss einfach warten bis es kompllett endvergoren ist.
[Editiert am 24.12.2011 um 10:01 von Bierhias]
____________________
|
 |
Antwort 41 |
|
Posting Freak  Beiträge: 824 Registriert: 14.6.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 24.12.2011 um 11:42 |
|
|
Hallo,
mein laufender Versuch mit der Zuckerlösung dient ja lediglich der
Ursachenforschung. Bislang zeigte er, dass die gängigen Speiserechner
wahrscheinlich mindestens 0,5 g/l CO2 überkarbonisieren.
Trotzdem habe ich mir nun mal die Arbeit gemacht und die Überkarbonisierung
28 meiner Sude in einem Diagramm festgehalten. Auch hier fällt auf, dass
die minimale Überkarbonisierung bei immerhin einem Sud mit 0,5 g/l CO2
gemessen wurde.
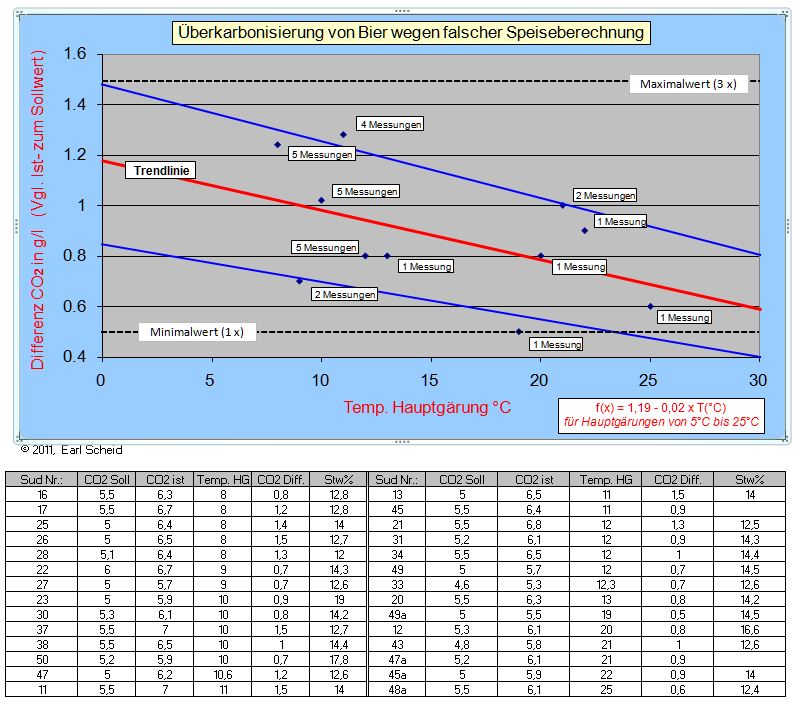
Nicht alle Druckgärungen hatte ich per Druckprüfflasche überwacht. Bei
einigen Messungen wurde die Prüfflasche undicht oder es wurde aus
Bequemlichkeit einfach nicht protokolliert. Erst nach Sud #10 begann ich
mit der Überwachung.
Punkte im Diagramm mit den Vermerk [x Messungen] stellen den Mittelwert
aller Messungen bei gleicher Hauptgärungs-Temperatur dar. Aus den Punkten
habe ich eine Trendlinie für Hauptgärungen von 5°C bis 25°C ermittelt:
f(x) = 1,19 - 0,02 * T (°C)
Bislang bin ich der Meinung, dass dieser Wert von der gewünschten Rezens
abzuziehen ist, bevor man die Speiserechner bemüht.
@ Matthias: Meine Prüfflaschen zeigten jeweils den Enddruck an, der erst
ermittelt wurde wenn auch nach langer Zeit keine Druckzunahme mehr
ersichtlich war. Dies hatte ich mir stets mittels Diagramme deutlich
gemacht und überwacht (Diagramme wie sie auf Seite 1 zu sehen sind). Alle
Speiseberechnungen erfolgten mit meinem Speiserechner. Dies war der erste
Speiserechner für Hobbybrauer, der den Endvergärungsgrad der Speise mit in
die Speiserechnung einbezog. Der EVG wird mittels sorgfältig ausgeführter
Schnellvergärungsprobe ermittelt. Das von Dir geschilderte Problem war mir
also schon sehr früh (2006) bekannt und ich hatte es mit diesem neuen Speiserechner und auch mit anderen Berechnungstools
(Rezeptmaker, RefraktoSP u.s.w.) damals endgültig beseitigt. Damit wurde
ein Bombenbau ausgeschlossen und es wurde sogar ein Aufspeisen noch nicht
endvergorener Jungbiere zuverlässig ermöglicht (Kombination aus
Grünschlauchen und Aufspeisen).
LG
Earl
[Editiert am 24.12.2011 um 12:20 von Earl]
____________________ PS: HIER gehts zur Tauschbörse für Hobbybrauer 
|
|
|
Posting Freak  Beiträge: 824 Registriert: 14.6.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 3.1.2012 um 15:22 |
|
|
So, ich habe mal auf die Druckprüfflasche geschaut. Es scheint sich zu
bestätigen, dass die Berechnung der gelösten Kohlensäure in Wasser/Alkohol
temperaturabhängig richtig ist. Dieser Part der Speiseberechnung scheint
also zu stimmen. Es liegen folgende Werte vor:
1) Temp. 19,5°C, abgelesener Druck: 2,75 bar => 6,3 g CO2/l
2) Temp. 9,0°C, abgelesener Druck: 1,7 bar => 6,3 g CO2/l (die Flasche
wurde diesmal kräftig geschüttelt).
Es bleibt also bei der Übercarbonisierung von 0,5 g/l. An einer
CO2-Übersättigung kann es nicht gelegen haben, die Zuckerlösung war zu
Versuchsbeginn ja entgast. An der Berechnung der gelösten Kohlensäure, wie
sich nun zeigt, auch nicht.
Einzige bisherige Erklärung: Bei der Vergärung von Zucker entsteht mehr CO2
als bislang angenommen !?! Was ist das blos für ein Zucker ?
Laut meiner Tabelle oben zeigt sich zudem regelmäßig eine
Übercarbonisierung von mehr als 0,5 g/l. Spricht dies etwa für 0,5 g/l +
CO2-Übersättigung? ____________________ PS: HIER gehts zur Tauschbörse für Hobbybrauer 
|
|
|
Posting Freak   Beiträge: 675 Registriert: 25.10.2010 Status: Offline |
 |
erstellt am: 3.1.2012 um 17:31 |
|
|
Hallo Earl - tolle Sache, damit hast Du den Fehler schon mal
ausgeschlossen. Hinsichtlich zuviel CO2 ist mir noch eine Sache
eingefallen: die Hefe ist ein fakultativ anaerober Mikroorganismus, d.h.
wenn O2 vorhanden, dann wird die Hefe den Zucker vollständig zu CO2
oxidieren und es wird mehr CO2 entstehen als beim Gärungsstoffwechsel. Die
Formeln zur CO2-Berechnung sind auf einen reinen Gärungsstoffwechsel
ausgelegt (rund 50:50 Ethanol:CO2). Beim Befüllen der Flaschen wird
zwangsläufig etwas O2 eingetragen und das Verhältnis Ethanol:CO2 könnte
sich dadurch verringern, da mehr CO2 gebildet wird. Evtl. ist das die
Lösung des Problems? Weiterhin: hattest Du Gelegenheit die "Hefe veratmet
sich selbst" Theorie zu testen?
Gruß
Sandro
____________________
|
 |
Antwort 44 |
|
Posting Freak   Beiträge: 675 Registriert: 25.10.2010 Status: Offline |
 |
erstellt am: 3.1.2012 um 17:39 |
|
|
Die Hefe kann den gebildeten Ethanol in Anwesenheit von O2 sogar weiter
oxidieren, wobei wiederum CO2 entsteht - das macht die Sache auch nicht
einfacher. Ein direkter Vergleich zwischen einem O2-freien und einem
belüfteten Ansatz wäre mal ganz interessant.
Gruß
Sandro
____________________
|
 |
Antwort 45 |
|
Junior Member  Beiträge: 32 Registriert: 10.10.2005 Status: OfflineGeschlecht:  |
 |
erstellt am: 3.1.2012 um 17:51 |
|
|
Hallo Earl,
nach Balling entstehen ja durchschnittlich aus 2,0665 g Zucker 1g Alkohol,
0,9565g CO2 und 0,11g Hefe. Zu Beginn der Gärung -vor allem wenn noch viel
Sauerstoff vorhanden ist und die Temperatur vom Anstellen noch etwas höher
ist - wird sicher etwas mehr Hefe gebildet als diese 0,11g pro 2,0665g
Zucker. Zum Ende der Hauptgärung vermehrt sich ja die Hefe nicht mehr so
sehr, so dass hierfür kaum noch Zucker abgezweigt wird und Anteilsmäßig
eher mehr Alkohol und CO2 entstehen. Die 0,11g sind eben der Durchschnitt
über den gesamten Gärverlauf.
Angenommen, die Hefe würde sich zum Ende hin gar nicht mehr vermehren, dann
hätte man für den theoretisch maximal möglichen Wert für die CO2
Entstehung die Summenformel:
C6H12O6 (180,16g/mol) ----> 2 C2H5OH (2*46,7g/mol) + 2 CO2
(2*44,1g/mol)
Bei Verwendung von Glucose als Speise entstünden also ohne Hefevermehrung
aus 2,0665g Zucker maximal 1,057g Ethanol und 1,007g CO2. (statt 1g und
0,9656g, also 4,3% mehr CO2)
Bei Verwendung eines Disaccharids sieht es analog dann so aus:
C12H22O11 (342,30g/mol) + H2O --> 4 C2H5OH (4*46,7g/mol) + 4 CO2
(4*44,1g/mol)
Es enstehen aus z.B. 2,0665g Maltose maximal 1,128g Alkohol und 1,065g CO2.
(statt 1g und 0,9656g, also 10% mehr CO2)
Für 3fach-Zucker enstünde dann noch ein wenig mehr Alkohol und CO2 als mit
der Durchschnittsformel nach Balling.
Ich nehme an, je niedriger die Temperatur und je weniger Hefe bei der
Nachgärung eingesetzt wird, desto weniger Hefe wird dann durch Vermehrung
enstehen (im Vergleich zum Beginn der Hauptgärung).
Aus Deinen gewünschten 5,8g/l CO2 entstünden also ohne Hefevermehrung aus
der Glukoselösung 5,8g/l CO2 * 1,065g / 0,9565g = 6,5 g/l CO2
Tatsächlich waren es aber nur 6,3 g/l CO2, was einem Faktor von 1,032 /
0,9565 entspräche.
Deine Probe war zwar nicht mit Sauerstoff belüftet -da entgast- welcher für
die Hefevermehrung förderlich hätte sein können, jedoch enthielt sie zu
Beginn der Gärung auch kaum Ethanol, welcher die Hefevermehrung
unterdrücken könnte.
Bei realem Bier und realer Nachgärung sähe das dann auch wieder etwas
anders aus. Zudem dürfte hier dann die 10%ige CO2-"Überproduktion" nur auf
die zugesetzte Speise bezogen werden und natürlich nicht auf die gesamte
CO2 g/l Konzentration berechnet (also nicht einfach mal 1,1 multipliziert)
werden.
Frohes Neues!
|
 |
Antwort 46 |
|
Senior Member  Beiträge: 223 Registriert: 24.5.2010 Status: OfflineGeschlecht:  |
 |
erstellt am: 3.1.2012 um 17:57 |
|
|
| Zitat von muldengold, am 3.1.2012 um
17:39 | Die Hefe kann den gebildeten Ethanol
in Anwesenheit von O2 sogar weiter oxidieren, wobei wiederum CO2 entsteht -
das macht die Sache auch nicht einfacher. Ein direkter Vergleich zwischen
einem O2-freien und einem belüfteten Ansatz wäre mal ganz interessant.
Gruß
Sandro |
Hallo Sandro,
ich kann euren Ausführungen leider nicht komplett folgen (ist mir zu hoch)
aber ich wollte fragen ob Du auf Deiner Homepage (maischemalzundmehr) die
Berechnung der Kanonisierung formelmäßig schon angepasst hast. Mir kommt es
so vor als ob weniger Speise oder Zucker nun herauskommt bei Eingabe in das
Tool.
Bis denne Henne
|
 |
Antwort 47 |
|
Moderator   Beiträge: 9088 Registriert: 14.8.2008 Status: OfflineGeschlecht:  |
 |
erstellt am: 3.1.2012 um 18:08 |
|
|
Hi Leute,
wie sieht es mit den internen Reservekohlenhydraten der Hefe aus? In den
Hefezellen sind deutlich höhere Zuckerkonzentrationen, wie im Bier zu
verzeichnen. Die Hefe legt Glykogen und Trehalose als Reservebrennstoff an.
Während einer Reifung kann dieser Brennstoff natürlich noch teilweise
verbraucht werden, was dann zu einer "kleinen" Überkarbonisierung
führt..?
m.f.g
René
____________________
"Fermentation und Zivilisation sind untrennbar verbunden"
(John Ciardi)
|
 |
Antwort 48 |
|
Posting Freak   Beiträge: 675 Registriert: 25.10.2010 Status: Offline |
 |
erstellt am: 3.1.2012 um 18:38 |
|
|
Hi Rene, genau das meine ich mit "Hefe veratmet sich selbst".
@Henne: nein, in meinem Rechner wird bisher nichts angepasst. EDIT: mal
sehen was hier am Ende der Diskussion herauskommt, vielleicht können wir
uns auf einen Korrekturfaktor einigen. 
Gruß
Sandro
[Editiert am 3.1.2012 um 20:01 von muldengold]
____________________
|
 |
Antwort 49 |
|




 Startseite
Startseite
 Forumsübersicht
Forumsübersicht
 Impressum
Impressum