Administrator   Beiträge: 10493 Registriert: 23.10.2005 Status: OnlineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 17:01 |
|
|
Hallo, zusammen,
da diese Frage hier immer wieder mal aufgetaucht ist, habe ich hier
exemplarisch den Vergleich der Druckverläufe, wie er bei mir typisch ist,
aufgezeichnet und visualisiert. Das ausgegorene Bier (Alt mit 13°P
Stammwürze, verwendete Hefe: Brewferm TOP) wurde mit Traubenzucker auf 5,1
g CO 2 pro Liter karbonisiert. Das Bier stand bei 20,5 bis 21°C.
Das CC Keg habe ich auf 1 bar vorgespannt, um den Deckel dicht zu
bekommen.
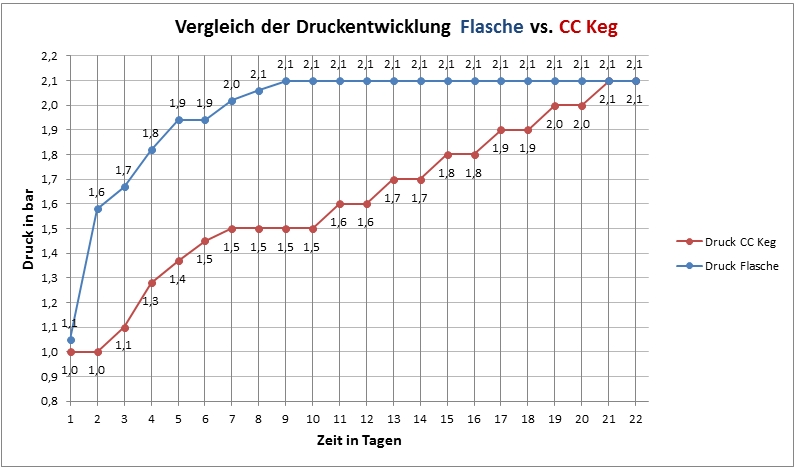
Dieses Verhalten spielt sich mehr oder weniger immer so ab, das CC hinkt
also deutlich hinterher. Der Druck wurde jeweils auf 20°C normiert. Bitte
nicht unbedingt Rückschlüsse auf Eure Gärdauer ziehen. Die tatsächliche
Gärdauer hängt ja von verschiedenen Faktoren ab, diese Darstellung ist
exemplarisch und soll lediglich aufzeigen, dass das CC Keg hinsichtlich der
Nachgärung träger ist als die Nachgärung in der Flasche.
Viele Grüße
Michael
[Editiert am 6.6.2014 um 16:23 von tauroplu]
____________________ „Lass die anderen mit Fichten- und Tannensprossen würzen, der Hopfen ist
das Beste, was die Natur uns bietet.“
Aus "Das Erbe des Bierzauberers" von Günther Thömmes, Gmeiner Verlag
|
|
|
Senior Member   Beiträge: 192 Registriert: 27.5.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 17:08 |
|
|
Tolle Arbeit!
Edit: Aber es sind doch Bar oder?
[Editiert am 5.6.2014 um 17:09 von hblockx]
|
 |
Antwort 1 |
|
Senior Member   Beiträge: 101 Registriert: 13.4.2013 Status: OfflineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 17:11 |
|
|
Hallo Michael,
ist die Einheit mit mbar richtig angegeben? Flasche und Keg aufgespeist?
Ralf
|
  |
Antwort 2 |
|
Administrator   Beiträge: 10493 Registriert: 23.10.2005 Status: OnlineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 17:12 |
|
|
Ihr habt natürlich Recht  ,
es sind bar, werde es gleich korrigieren.
Das ausgegorene Bier wurde mit Traubenzucker karbonisiert.
Gruß
Michael ____________________ „Lass die anderen mit Fichten- und Tannensprossen würzen, der Hopfen ist
das Beste, was die Natur uns bietet.“
Aus "Das Erbe des Bierzauberers" von Günther Thömmes, Gmeiner Verlag
|
|
|
Senior Member   Beiträge: 192 Registriert: 27.5.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 17:15 |
|
|
Das heißt wohl nun für mich, dass ich 3 Wochen auf mein gerade abgefülltes
Weizen im Keg warten muss  Die HG hat gerade mal 2,5 Tage gedauert, die
Wheat'n'Fruity ist ja ein echtes Arbeitstier!
Gruß,
Mirko
|
 |
Antwort 4 |
|
Administrator   Beiträge: 10493 Registriert: 23.10.2005 Status: OnlineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 17:19 |
|
|
Na, ja, das kommt aber sicherlich auch auf die verwendete Hefe und die
Gärtemperatur an, die ja bei einem Weizen vermutlich über 21°C liegen
dürfte.
____________________
„Lass die anderen mit Fichten- und Tannensprossen würzen, der Hopfen ist
das Beste, was die Natur uns bietet.“
Aus "Das Erbe des Bierzauberers" von Günther Thömmes, Gmeiner Verlag
|
|
|
Posting Freak   Beiträge: 756 Registriert: 8.4.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 17:41 |
|
|
|
|
 |
Antwort 6 |
|
Administrator   Beiträge: 10493 Registriert: 23.10.2005 Status: OnlineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 18:17 |
|
|
Ahhh...MIst! Und danke, Du glaubst gar nicht, wie ich diesen thread gesucht
und nicht gefunden habe...leider kann man keine posts verschieben...
____________________
„Lass die anderen mit Fichten- und Tannensprossen würzen, der Hopfen ist
das Beste, was die Natur uns bietet.“
Aus "Das Erbe des Bierzauberers" von Günther Thömmes, Gmeiner Verlag
|
|
|
Posting Freak   Beiträge: 1762 Registriert: 6.1.2013 Status: OfflineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 19:05 |
|
|
Hallo Michael und vielen Dank für deine Mühen die zu den gezeigten Kurven
führten.
Wie erklärst du Dir den unterschiedlichen Verlauf, was führt dazu ?
Grüsse
Bernd
|
  |
Antwort 8 |
|
Administrator   Beiträge: 10493 Registriert: 23.10.2005 Status: OnlineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 19:19 |
|
|
Meine Erklärung würde ich auf das unterschiedliche Oberflächen-/Volumenverhältnis stützen.
Gruß
Michael ____________________ „Lass die anderen mit Fichten- und Tannensprossen würzen, der Hopfen ist
das Beste, was die Natur uns bietet.“
Aus "Das Erbe des Bierzauberers" von Günther Thömmes, Gmeiner Verlag
|
|
|
Posting Freak   Beiträge: 5619 Registriert: 12.4.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 5.6.2014 um 20:07 |
|
|
Auch das Verhältnis Volumen/ Kopfraum wird ne Rolle spielen. Gas im
Kopfraum lässt sich komprimieren, Flüssigkeit nicht. Also sehr kleiner
Kopfraum im Verhältnis zum vergärenden Volumen -> schnellerer Anstieg
des gemessenen Drucks.
Jan
|
 |
Antwort 10 |
|
Senior Member   Beiträge: 102 Registriert: 10.12.2013 Status: Offline |
 |
erstellt am: 6.6.2014 um 07:53 |
|
|
| Zitat von JanBr, am 5.6.2014 um
20:07 |
Auch das Verhältnis Volumen/ Kopfraum wird ne Rolle spielen. Gas im
Kopfraum lässt sich komprimieren, Flüssigkeit nicht. Also sehr kleiner
Kopfraum im Verhältnis zum vergärenden Volumen -> schnellerer Anstieg
des gemessenen Drucks.
Jan |
Ich gehe auch stark davon aus, dass es an
der Kompression im Kopfraum liegt. Beim CC ist ja immer min. 1 Liter frei
(so ~5%) das ist bei 0,5er Falschen ja nicht der Normalfall.
Aber schöner Versuch, danke Micha!
|
 |
Antwort 11 |
|
Moderator   Beiträge: 9432 Registriert: 12.11.2008 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 08:11 |
|
|
Der Druck im Gasraum, sollte bei einer gegebenen Temperatur immer der selbe
sein, unabhängig vom Volumen, da sich immer das selbe Gleichgewicht
einstellt.
Er ist so groß wie der Dampfdruck bei gegebener Temperatur.
Der Druck einer Butangasflasche beleibt auch so lange konstant, wie noch
flüssiges Gas in der Flasche enthalten ist, da muss man nichts nachregeln,
obwohl der Gasraum immer größer wird (vorausgesetzt der Inhalt kühlt durch
das expandierende Gas nicht ab, dann kann es sogar sein, dass gar nicht
sgeht, aber das liegt an der Temperatur).
Bei sehr großem Gasraum ist die darin enthaltene Menge CO2 natürlich größer
und "fehlt" sozusagen im Bier, aber wenn der Gasraum nicht extrem groß ist
(Extremfall Atmosphäre), spielt das so gut wie keine Rolle angesichts der
riesigen Mengen CO2, die im Bier gelöst sind.
Oder anders ausgedrückt: Würde der Druck im Faß höher sein als in der
Flasche, würde sich so lange CO2 im Bier lösen, bis beide Drücke wieder
identisch sind. Bis auf das bißchen CO2, das im größeren Gasraum Platz
hat.
Mich macht dieser sehr interessante Versuch schon nachdenklich, da wir auch
oft in Fässern nachgären und das letzte Hefeweizen einen Tick zu süß
schmeckt und ein bißchen zu wenig CO2 hat, obwohl es 10 Tage bei
Raumtemperatur gelagert wurde.
Danke Michael für die Arbeit!
Stefan
[Editiert am 6.6.2014 um 08:19 von Boludo]
|
 |
Antwort 12 |
|
Posting Freak   Beiträge: 756 Registriert: 8.4.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 08:18 |
|
|
Richtig Stefan,
ich habe mir sogar mal die Mühe gemacht, diesen Anteil im Gasraum zu
berechnen und beim flüssigen Bier als CO2-Gehalt wieder abzuziehen. Mein
Ergebnis: Die rehnung geht trotzdem nicht auf. Offensichtlich steckt da
viel Theorie hinter und die Praxis verhält sich zumindest teilweise
anders.
Jüngstes Beispiel: Keg hat am Ende der Nachgärung bei 20°C 1,8 bar. Daraus
berechne ich einen CO2-Gehalt im Bier. Das Keg kommt in de Kühlung bei max.
2°C. Nach 3 Wochen messe ich den Druck. Berechnet, aus dem (vermeindlich)
bekannten CO2-gehalt des Bieres ca. 0,7 bar. Das Manometer sagt aber 1,1
bar. Man könnte sagen, es dauert, bis sich das CO2 löst und sich der Druck
im Kopfraum entsprechend ändert, aber auch nach 6 Wochen ist der Druck
genau 1,1bar.
Theorie ungleich Praxis ! Grund ??????
Ich habe mir fest vorgenommen, das Thema mal mit meinem Bruder - Master in
Chemie - zu bereden. Evtl. übersehe ich was bei meiner Theorie/Berechnung.
____________________
Grüße
Maddin
|
 |
Antwort 13 |
|
Moderator   Beiträge: 9432 Registriert: 12.11.2008 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 08:22 |
|
|
Man muss da immer ein wenig aufpassen, die ganzen Formeln gelten für ideale
Gase, die es gar nicht gibt.
Stefan
|
 |
Antwort 14 |
|
Moderator   Beiträge: 9432 Registriert: 12.11.2008 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 08:42 |
|
|
Hab grad noch mal den Artikel über Dampfdruck
angeschaut, wenn der Gasraum nicht extrem groß ist, sollte der Druck
immer gleich groß sein und hängt von der Temperatur ab, nicht vom
Gasvolumen.
Beispiel 50 Liter Keg:
In 50 Liter Bier sind ca 500 Liter CO2 enthalten, die je nach Temperatur
das Verlangen haben, die Flüssigkeit zu verlassen und so einen Druck
aufbauen.
Ob der Gasraum jetzt 50 mL oder 4 Liter groß ist, spielt da gar keine
Rolle, es fehlen höchstens ein paar Liter Gas in der Flüssigkeit für den
Druckaufbau.
Stefan, der jetzt seinen rasen Mähen geht
|
 |
Antwort 15 |
|
Moderator   Beiträge: 4024 Registriert: 7.4.2006 Status: Offline |
 |
erstellt am: 6.6.2014 um 08:43 |
|
|
Dass der Druck im Keg nicht so sinkt, wie die Theorie besagt, ist mir auch
schon aufgefallen. Ich lasse bei untergärigen die Nachgärung meist bei
Raumtemperatur laufen, und dann stellen sich so um die 1,7bar ein, wenn ich
auf 4,5g/l CO2 aufspeise. Wenn das Keg dann in den Kühlschrank bei ~0°C
wandert, sollte der Druck theoretisch auf unter 0,5bar sinken - tut er aber
nicht, sondern bleibt auch nach längerer Lagerung (mehrere Wochen) über
1bar. Erklärung habe ich leider auch keine.
____________________
Gruß vom Berliner
|
  |
Antwort 16 |
|
Posting Freak   Beiträge: 756 Registriert: 8.4.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 11:24 |
|
|
@Berliner: Ich werde es rausfinden, egal wie  ____________________ Grüße
Maddin
|
 |
Antwort 17 |
|
Posting Freak   Beiträge: 502 Registriert: 31.1.2013 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 11:33 |
|
|
Ich könnte mir auch vorstellen, dass der pH-Wert des Bieres einen Einfluss
auf die Löslichkeit von CO2 hat, da die entstehende Kohlensäure (H2CO3)
zumindest teilweise neutralisiert wird ( je alkalischer, desto mehr) zu
Hydrogencarbonat HCO3(-) oder im Extremfall Carbonat CO3(2-). Somit wird
eventuell teilweise CO2 dem Gasgleichgewicht zwischen Bier und dem Raum
darüber entzogen.
Allerdings wüsste ich zugegebenermaßen nicht, warum sich die pH-Werte
zwischen Flaschen und Kegs wesentlich unterscheiden sollten. Wie ist denn
normalerweise der pH-Verlauf während der Gärung? Vielleicht spielt das ja
eine Rolle.
____________________
Johnny H. - All Grain Brewing
|
 |
Antwort 18 |
|
Posting Freak   Beiträge: 5619 Registriert: 12.4.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 11:35 |
|
|
| Zitat von Boludo, am 6.6.2014 um
08:11 | Der Druck im Gasraum, sollte bei einer
gegebenen Temperatur immer der selbe sein, unabhängig vom Volumen, da sich
immer das selbe Gleichgewicht einstellt.
Er ist so groß wie der Dampfdruck bei gegebener Temperatur.
Der Druck einer Butangasflasche beleibt auch so lange konstant, wie noch
flüssiges Gas in der Flasche enthalten ist, da muss man nichts nachregeln,
obwohl der Gasraum immer größer wird (vorausgesetzt der Inhalt kühlt durch
das expandierende Gas nicht ab, dann kann es sogar sein, dass gar nicht
sgeht, aber das liegt an der Temperatur).
Bei sehr großem Gasraum ist die darin enthaltene Menge CO2 natürlich größer
und "fehlt" sozusagen im Bier, aber wenn der Gasraum nicht extrem groß ist
(Extremfall Atmosphäre), spielt das so gut wie keine Rolle angesichts der
riesigen Mengen CO2, die im Bier gelöst sind.
Oder anders ausgedrückt: Würde der Druck im Faß höher sein als in der
Flasche, würde sich so lange CO2 im Bier lösen, bis beide Drücke wieder
identisch sind. Bis auf das bißchen CO2, das im größeren Gasraum Platz
hat.
Mich macht dieser sehr interessante Versuch schon nachdenklich, da wir auch
oft in Fässern nachgären und das letzte Hefeweizen einen Tick zu süß
schmeckt und ein bißchen zu wenig CO2 hat, obwohl es 10 Tage bei
Raumtemperatur gelagert wurde.
Danke Michael für die Arbeit!
Stefan
|
Dein Vergleich mit der Gasflasche hinkt etwas, denn du hast ja bei einer
Gasflasche immer genug Gas um ein Gleichgewicht einzustellen. Bei der
Gärung bildet sich das CO2 langsam. Vergleiche ich eine Gasraum von 0,1
Liter mit einem Gasraum von einem Liter, brauche ich bei 1 Liter 10 mal
mehr CO2 als bei 0,1l. Es wäre also Interessant ob das Verhältnis Kopfraum
zu Volumen gleich ist. Ein weiterer Grund, der theoretisch auch eine Rolle
spielt ist der hydrostatische Druck. Immerhin bei 1m Wassersäule 0,1
bar.
Jan
|
 |
Antwort 19 |
|
Senior Member   Beiträge: 366 Registriert: 11.5.2012 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 11:38 |
|
|
Ich lehn mich mal aus dem Fenster.
Das Dampfdruckgesetz besagt ja, das sich Druck aus den Partialdrücken
zusammen setzt. Jetzt haben wir aber nicht nur CO2 sondern auch Wasserdampf
und Ethanoldampf im Keg. Auch wenn es nur geringe Temperaturen sind,
entsteht immer eine Damphase über dem Flüssigkeitsspiegel bis zur
Sättigung. Der "Sättigungsdampfdruck". Da sich die Gase beim absenken der
Temperatur nicht gleich verhalten, denke ich das so die Unterschiede
zwischen Theorie und Praxis entstehen. Zusätzlich kommt dazu, das Wasser
und Alkohol verdampft.
Ist eben nur ne vermutung, könnte aber ein Ansatz sein.
Grüße
Chris
[Editiert am 2.7.2014 um 12:52 von BasherMcGee]
____________________ Homebrewed Stuff
|
 |
Antwort 20 |
|
Posting Freak   Beiträge: 546 Registriert: 2.2.2013 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 12:14 |
|
|
Bin jetzt den Faden von Anfang an durchgegangen, und habe in BasherMcGees
letztem Beitrag genau das gelesen, was mir auch in den Sinn gekommen ist:
Was wir messen, ist ja die Summe der Partialdrücke. Und da spielen neben
CO2 auch noch z.B. Wasser und Ethanol, aber auch andere Luftbestandteile,
hier wohl vor allem Stickstoff, eine Rolle. Dass sich der Druck also nicht
auf den eigentlich "errechneten" CO2-(Partial)-Druck einstellt, sondern
höher bleibt, ist nicht so verwunderlich...
Das ganze erklärt natürlich nicht, warum der Druck in der Flasche schneller
hoch geht, als im Fass.
|
 |
Antwort 21 |
|
Posting Freak   Beiträge: 756 Registriert: 8.4.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 12:20 |
|
|
| Zitat von BasherMcGee, am 6.6.2014 um
11:38 | Ich lehn mich mal aus dem Fenster.
Das Dampfdruckgesetz besagt ja, das sich Druck aus den Partialdrücken
zusammen setzt. Jetzt haben wir aber nicht nur CO2 sondern auch Wasserdampf
und Ethanoldampf im Keg. Auch wenn es nur geringe Temperaturen sind,
entsteht immer eine Damphase über dem Flüssigkeitsspiegel bis zur
Sättigung. Der "Sättigungsdampfdruck". Da sich die Gase beim absenken der
Temperatur nicht gleich verhalten, denke ich das so die Unterschiede
zwischen Theorie und Praxis entstehen. Zusätzlich kommt dazu, das Wasser
und Alkohol durch Sublimation verdampft. Als Beispiel, Die Wäsche auf der
Wäscheleine im Winter bei minusgraden trocknet trotzdem, wenn auch
langsamer. Oder das Brot, das im Kühlschrank schneller austrocknet als im
Brotkasten.
Ist eben nur ne vermutung, könnte aber ein Ansatz sein.
Grüße
Chris |

Wow, das klingt für mich absolut plausibel. Klar haben wir noch andere Gase
und Dämpfe im Kopfraum. An der Stelle macht es dann auch einen Unterschied,
ob man eben in einer Flasche ein paar ml Kopfraum hat oder im Keg evtl.
2-3l. ____________________ Grüße
Maddin
|
 |
Antwort 22 |
|
Senior Member   Beiträge: 366 Registriert: 11.5.2012 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 12:38 |
|
|
Stimmt.
Die Erklärung von Jan mit der Flüssigkeitssäule klingt für mich erstmal
logisch. Somit wäre die Nachgärung durch den höheren Druck schon etwas
gehemmt. Der Kopfraum zum Volumen ist für mich auch der größte
Anhaltspunkt. Der muss sich erstmal mit Gas füllen und kompremiert sich
anschliessend. Vieleicht ist zusätzlich, die größere Masse auch etwas
träge. Ist nur ne Vermutung.
Was den Druck beim abkühlen der Fässer angeht:
Wenn mans genau nimmt muss man auch die Volumenkontraktion mit einbeziehen.
Nicht nur die der Flüssigkeit, sondern auch die des Fasses. Letztere ist
wahrscheinlich nicht so groß aber dennoch vorhanden. Und bei Metallen
bestimmt stärker bemerkbar ist, als bei Glas.
Ein taugliches Beispiel hätt ich noch. Hab im Moment meinen Zapfhahn
verliehen und bin auf meinen Picnic-Hahn angewiesen. Das Fass steht bei
2°C. Hab beim ersten mal Zapfen soviel CO2 abgelassen, das ein anständiges
Bier entsteht. Das ist jetzt 6 Tage her. beim 2. mal musste ich wieder
ablassen damit keine Schaumorgie entsteht. Genauso hatt es sich auch in den
letzten Tagen verhalten. Das witzige dabei ist das die Carbonisierung
bisher noch nicht merkbar gelitten hat.
Solange kein Gegendruck von einer CO2-Flasche kommt, entbindet es sich, bis
sich der Sättigungsdruck eingestellt hat. Der wiederum ist
Temperaturabhängig.
Auf diese Weise, wenn jeden Tag nur eine geringe Menge Bier gezapft wird
(0,5l), lässt sich bestimmt 1/3 des Inhalts nur mit dem Sättigungsdruck
zapfen. Dann dürfte das ganze CO2 verschwunden sein und das Bier ist dann
eben schal.
Das dürfte solange funktionieren bis sich irgendwann im Fass, der
Umgebungsdruck von ca. 1 bar eingestellt hat. Dann gibt es kein
Überdruckverhalten mehr. Es sei denn man stellt es in eine wärmere
Umgebung.
Grüße
Chris
____________________
Homebrewed Stuff
|
 |
Antwort 23 |
|
Posting Freak   Beiträge: 756 Registriert: 8.4.2011 Status: OfflineGeschlecht:  |
 |
erstellt am: 6.6.2014 um 13:06 |
|
|
Dazu hätte ich auch noch etwas. Wenn die Nachgärung unter Druck gehemmt
wird, also langsamer abläuft, ist das Keg auf jeden Fall benachteiligt,
wenn man - so wie ich - nach dem Speisen und Füllen des Kegs mit CO2
vorspannt, um den Deckel dicht zu kriegen.
Das habe ich hier im forum schon öfter gelesen. So ca. 1 bar CO2 auf das
Faß, damit der Deckel schließt. D.h. die Nachgärung im Faß beginnt ab
Sekunde 0 bei 1 bar Druck. In der Flasche macht das keiner, so dass sich
die Hefe am Anfang bei (mehr oder weniger) Atmosphärendruck austoben kann.
Später ist durch die NG auch Druck in der Pulle und der Vorgang gleicht
sich an.
Daher die Frage an tauroplu: Hattest Du bei Deinem Experiment das Keg auch
vorgespannt? ____________________ Grüße
Maddin
|
 |
Antwort 24 |
|




 Startseite
Startseite
 Forumsübersicht
Forumsübersicht
 Impressum
Impressum